Zunächst fällt die große Unterschiedlichkeit dieser Wahrscheinlichkeitsbereiche je nach der wertmäßigen bzw. energetischen Beschaffenheit des Atoms auf. Man erkennt auch sofort den großen Unterschied zum früheren Kügelchenmodel von 1910, bei dem das Elektron je nach Zustand einfach in verschiedenen Entfernungen um ein festen Kern kreiste.
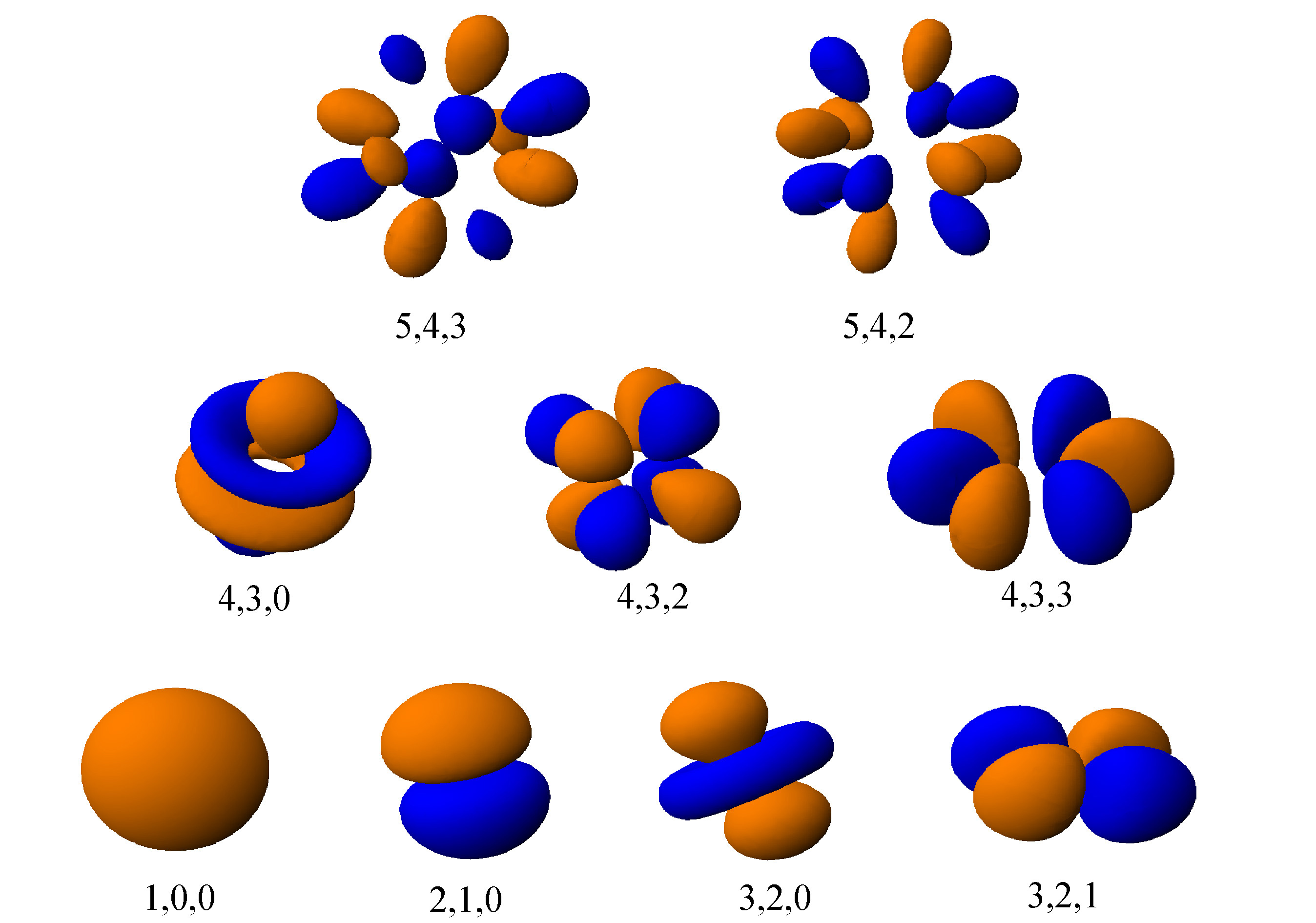
Negative Wertbereiche der PSI-Funktion sind blau, positive braun.
Die Wahrscheinlichkeit, das Elektron an einem bestimmten Ort im Raum anzutreffen, ist durch das (immer positive) Quadrat des PSI-Wertes gegeben, sie ist also in den blauen und braunen Bereichen gleich.
Eine im gesamten Raum verteilte 3-D Raumwelle ist nur durch Tricks darstellbar. Manthey lässt deshalb gegen null gehende Werte der PSI-Funktion fort. Innerhalb eines Farbereichs sind die absoluten PSI-Werte größer als ein Grenzwert, außerhalb sind sie kleiner. Man muß sich die blau-braun-Bereiche jeweils abwechselnd denken, da die PSI-Funktion ja eine Wellenfunktion ist. Zwischen orange und blau durchlaufen die PSI-Werte also den Null-Wert. An Orten mit Null-Wert ist das Elektron mit Sicherheit nicht. Mehrere Bereiche gleicher Größe bedeuten, dass das Elektron hier oder da oder dort anzutreffen ist. In einem Bild ist jeweils die Summe der Raumintegrale aller quadratischen PSI-Werte über alle Bereiche = 1, denn irgendwo muss das Elektron mit diesen Eigenschaften ja sein.
Es gibt unendlich viele mögliche quantische Zustände, also unendlich viele mögliche Bildchen, sogenannte virtuelle Zustände für das Wasserstoffatom mit einem Elektron, jedoch ist der Zustand 1,0,0 der energetisch günstigste. Deshalb wird dieser Zustand in allen Atomen von den ersten Elektronen angenommen. Die Reihenfolge, in der die Orbitale genutzt werden, entspricht der jeweils nächst höheren Energiestufe, die durch Aufnahme von Photonen erreicht werden kann.